~パーキンソン病などの神経変性疾患の予防・治療へ~
順天堂大学大学院医学研究科・オートファジー調節化合物探索研究講座の古屋徳彦助教、神経学講座の服部信孝教授らの研究グループは、オートファジーレセプター(注1)の一つNDP52(注2)がミトコンドリア内に侵入し、ミトコンドリアRNA poly(A)ポリメラーゼ(MTPAP)(注3)と相互作用することで不良ミトコンドリア選択的なオートファジー(注4)(マイトファジーという)を促進することを発見しました。本研究成果は不良ミトコンドリア蓄積を原因とするパーキンソン病などの神経変性疾患の予防・治療につながるものと期待されます。本研究は、欧州分子生物学機構(EMBO)公式ジャーナルである「EMBO Reports」のオンライン版(2018年10月11日付)で公開されました。
【本研究成果のポイント】
NDP52のSKICHドメイン結合タンパク質としてMTPAPを同定
NDP52が不良ミトコンドリア内部に侵入することを発見
NDP52とMTPAPの相互作用がマイトファジーを促進することを発見
【背景】
ミトコンドリアは、細胞が必要とするエネルギーの大部分を作り出すほか、様々な分子の代謝に関わる生命活動に重要な細胞内小器官です。一方、傷ついたミトコンドリアや異常なミトコンドリアは細胞にとって有害なため、細胞はこれらの不良ミトコンドリアを取り除き、ミトコンドリアの品質を管理する必要があります。マイトファジーは選択的に不良ミトコンドリアを分解するミトコンドリア品質管理機構で、不良ミトコンドリアをオートファゴソームと呼ばれる二重膜構造で包みこみ、消化酵素を含む細胞内小器官であるリソソーム(注5)へと送り分解する経路です。マイトファジーが働かなくなると、細胞内に 不良ミトコンドリアが蓄積し、神経変性疾患などを引き起こします。そのため、マイトファジーは不良ミトコンドリアが関わる疾患群の病態との関わりが注目されているとともに、治療法開発の糸口としても注目されており、その分子機構を明らかにすることが重要な課題となっています。
現在、ほ乳類の細胞において最もその分子機構が明らかにされているマイトファジーはPINK1/Parkin介在性マイトファジーと呼ばれる機構です。PINK1とParkinはともに家族性パーキンソン病の原因遺伝子から合成されるタンパク質で、協働して不良ミトコンドリアをマイトファジーに導く目印(ユビキチン鎖)を付加する働きがあります。目印の付けられたミトコンドリアには目印とオートファゴソーム膜の両方に結合するオートファジーレセプターと呼ばれる分子が結合し、不良ミトコンドリアをマイトファジーへと導きます。私たち研究グループは、オートファジーレセプターの一つであるNDP52が不良ミトコンドリアの一部のみに局在するという、他のオートファジーレセプターと異なる独特の挙動をとることに着目し、NDP52のマイトファジーにおける役割を解明する目的で今回の研究を進めました。
【内容】
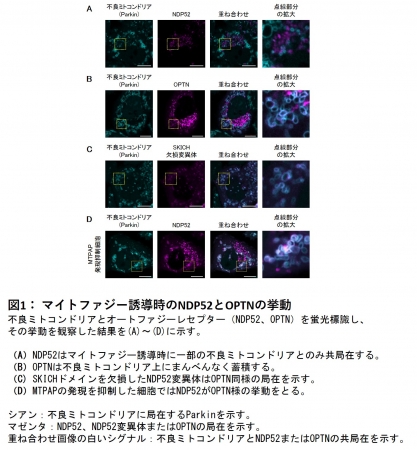
まず、培養細胞を用い、PINK1/Parkin介在性マイトファジー誘導時におけるオートファジーレセプターの挙動をタイムラプス顕微鏡観察によって調べました。その結果、同じオートファジーレセプターであってもOPTN(注6)は不良ミトコンドリア上にまんべんなく蓄積する挙動をとるのに対し、NDP52は一部のミトコンドリアに一定時間局在するという挙動をとることを見出しました(図1A、B)。またNDP52のSKICHドメイン(注7)という部分を欠損させた変異体ではOPTNと類似の挙動に変化することから(図1C) 、NDP52特有の挙動はSKICHドメインによるものと考えました。
そこで、SKICHドメインを介してNDP52と結合するタンパク質を探索した結果、ミトコンドリアRNA poly(A)ポリメラーゼ(MTPAP)というタンパク質を同定しました。MTPAPの発現を抑えた細胞においても、NDP52の挙動はOPTNと類似したものに変化することから(図1D)、NDP52特有の挙動はSKICHドメインを介したMTPAPとの結合によるものと示唆されました。
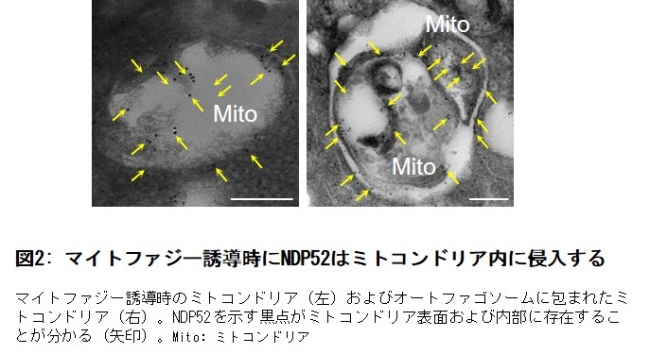
しかしながら、細胞質に存在するNDP52とミトコンドリア内に局在するMTPAPは、ミトコンドリアの外膜、内膜という2つの膜に隔てられて通常出会うことは出来ません。NDP52とMTPAPがどうやって結合するのかを検討した結果、プロテアソーム(注8)というタンパク質分解酵素複合体によってミトコンドリア外膜に穴があくことで、NDP52がミトコンドリア内部に侵入することが分かりました(図2)。NDP52とMTPAPが結合した複合体は、NDP52単独よりオートファゴソーム膜上に存在するタンパク質LC3との親和性が高く、NDP52-MTPAP複合体が形成されたミトコンドリアはよりマイトファジーを受けやすいことが分かりました。
以上の結果から、NDP52は従来から報告のあったユビキチン鎖とLC3との結合を介したオートファジーレセプターとしての働きに加え、MTPAPとの結合を介した働きによりマイトファジーを促進していることが明らかとなりました(図3)。
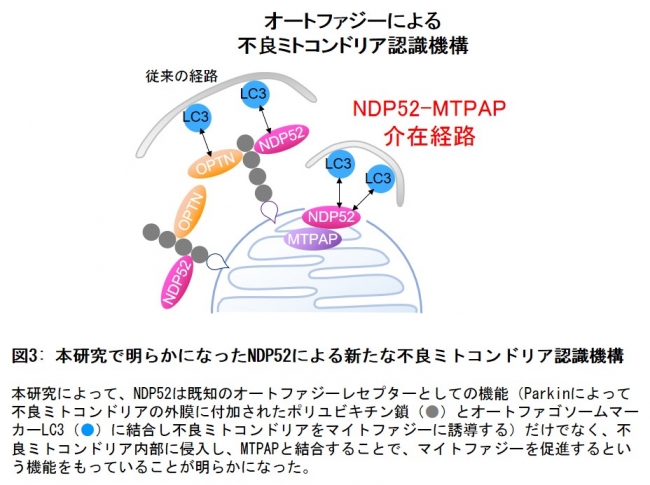
今回の研究結果は細胞が不良ミトコンドリアを取り除く新しいメカニズムを見つけたというだけでなく、細胞質のタンパク質がミトコンドリア内部(マトリックス)に侵入し、ミトコンドリア内部のタンパク質と相互作用するという機構が存在することを示した世界初の知見であり、細胞生物学的に非常に重要な発見であると言えます。
【今後の展開】
不良ミトコンドリアを正常なミトコンドリアと区別し、迅速に取り除くことは、細胞の健康にとってとても重要です。今回、私たち研究グループが発見したものを含めて、細胞は複数の仕組みを用いて分解するべきミトコンドリアに目印を付けて、マイトファジーによって取り除いています。これらの仕組みがどのように働き、またどのように使い分けられているのか明らかにすることで、不良ミトコンドリアの蓄積によって引き起こされる疾患への理解を深めることができるはずです。今後さらにマイトファジーの分子機構に対する研究を進めて、これらの疾患の原因究明、予防・治療法開発に繋げていきたいと考えています。
【用語説明】
(注1) オートファジーレセプター : ユビキチンというタンパク質が複数結合した鎖(ポリユビキチン鎖)とオートファゴソームマーカータンパク質であるAtg8ファミリー(LC3またはGABARAPファミリータンパク質)と結合する性質を持ったタンパク質群。ポリユビキチン化されたタンパク質や細胞内小器官などをオートファゴソームの中に選択的に取り込ませる働きをする。
(注2) NDP52:オートファジーレセプターの一つ。細胞内に侵入した細菌選択的なオートファジー(ゼノファジー)に機能するオートファジーレセプターであり、PINK1/Parkin介在性マイトファジーにおいてはOPTNとともに必須のオートファジーレセプターとして働く。
(注3)ミトコンドリアRNA poly(A)ポリメラーゼ(MTPAP): ミトコンドリア内に存在するDNA(ミトコンドリアDNA)に遺伝情報が乗っている遺伝子をもとに、ミトコンドリア内で作られるメッセンジャーRNAにアデニンが複数連続した配列(poly(A))を付加する酵素。ミトコンドリアマトリックスに存在する。
(注4)オートファジー: オートファゴソームと呼ばれる二重膜構造によって、細胞成分や細胞内小器官を取り囲み、リソソームへ送って分解する機構。酵母からヒトまで進化的に保存されている生命現象である。
(注5)リソソーム: 内部に様々な消化酵素を含む細胞内小器官。細胞内外から輸送されてきた分子、細胞内小器官などをを分解する。
(注6)OPTN: オプティニューリンというオートファジーレセプターの一つ。筋萎縮性側索硬化症(ALS)の原因遺伝子の一つとしても知られている。
(注7)SKICHドメイン: NDP52のアミノ酸配列のうち、SKIPという酵素のカルボキシル末端と相同性の高い領域(ドメイン)のこと。 SKIP Carboxy Homologyドメインの略
(注8)プロテアソーム: ポリユビキチン化された不要なタンパク質を選択的に分解するタンパク質分解酵素複合体。
【論文】
掲載誌: 本論文は欧州分子生物学機構(EMBO)公式ジャーナルEMBO Reports電子版に2018年10月11日付けで掲載されました。
タイトル: NDP52 interacts with mitochondrial RNA poly (A) polymerase to promote mitophagy
日本語訳: 「NDP52はマイトファジーを促進するためにミトコンドリアRNA poly(A)ポリメラーゼと結合する」
著者: Norihiko Furuya1, Soichiro Kakuta, Katsuhiko Sumiyoshi, Maya Ando, Risa Nonaka,Ayami Suzuki, Saiko Kazuno, Shinji Saiki, Nobutaka Hattori
著者(日本語表記): 古屋徳彦(1)、角田宗一郎(1)、住吉克彦(1、2)、安藤真矢(1)、野中里紗(1)、
鈴木絢美(1)、数野彩子(1)、斉木臣二(1)、服部信孝(1)
所属: (1)順天堂大学、(2)常盤大学
DOI: 10.15252/embr.201846363
【謝辞】
本研究はJSPS科研費課題番号JP24500868、JP15K09325、JP24390224、JP15H04842、JP15H04843、MEXT科研費課題番号23111003、25111007の研究助成を受けて実施されました。
 公式フェイスブックページ
公式フェイスブックページ