明治大学農学部 西山康太郎助教、瀬戸義哉准教授らの研究グループ
■要 旨
- 明治大学農学部および同大学院農学研究科の西山康太郎助教、瀬戸義哉准教授、鈴木泰輝(博士後期課程3年)、加藤優佑(博士前期課程2年)、新開千紘(学部4年)、石川智也(博士前期課程1年)、来馬道生(博士後期課程3年)らの研究グループは、理化学研究所環境資源科学研究センターの萩原伸也チームディレクター、Jekson Robertlee博士、アメリカ・ソーク研究所のMarco Bürger博士、東京理科大学理学部の福井康祐准教授、横浜市立大学木原生物学研究所の浅見忠男特任教授らとの共同研究により、植物が生産するシグナル分子群「ストリゴラクトン(SL)」の働きを試験管内で素早く定量的に解析する技術の開発に成功しました。
- 本成果で報告した技術を用いることで、SLやそれらが作用する受容体タンパク質が「どの程度、どのように働くのか?」を、溶液を混ぜて汎用的な装置で測定するだけの簡便な操作で行えるようになりました。また、植物は根からさまざまな有機化学物質を分泌していますが、その中からSLを選択的に検出するセンシング技術への応用も達成しました。
- 本成果は、植物科学分野における国際学術誌The Plant Journalに2025年12月3日にオンライン掲載されました。
■概 要
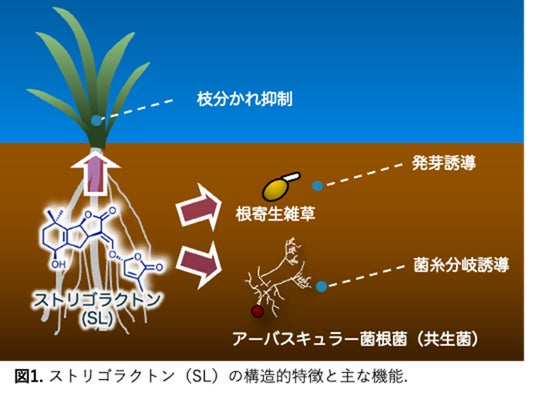
ストリゴラクトン(SL)類は、さまざまな植物が普遍的に生産しており、枝分かれを抑制する植物ホルモン※1として働きます。また、根から分泌され、微生物や根寄生植物に対するシグナル分子としても振る舞います。このようにさまざまな場面で機能を示すSLは、植物にとって非常に重要な分子であるため、その働きが世界中で詳細に調べられています。しかし、SLやそれらが作用する受容体タンパク質が「どの程度、どのように働くのか?」というメカニズムについては、未解明の点や未解決の課題が多く残されています。本成果では、SLやSL受容体の機能を、素早くかつ正確に解析する技術の開発に成功し、詳細なメカニズムの解明に貢献しました。また、植物は根からさまざまな有機化学物質を分泌していますが、その中からSLを選択的に検出するセンシング技術への応用も達成し、新たな生物(生理)活性分子を探し出すための優れた方法になることが期待されます。
本研究は、JST ACT-X「環境とバイオテクノロジー」領域 (JPMJAX22BH、研究代表者:西山康太郎)、 JSPS科研費 (19K05852, 22H02276, 23H05409, 24H00878、研究代表者:瀬戸義哉;22K14788、研究代表者:Jekson Robertlee), JST創発的研究支援事業 (JPMJFR211S、研究代表者:瀬戸義哉)、三菱財団、加藤記念バイオサイエンス振興財団の助成を受けて実施されました。
■研究の背景
SLは、さまざまな植物が普遍的に生産しており、枝分かれを抑制する植物ホルモン※1として働きます。また、根から分泌され、アーバスキュラー菌根(AM)菌の菌糸分岐を誘導し、共生を促進するシグナル分子としても機能します。一方で、植物の根へ寄生することで養分や水分を奪う根寄生植物は、宿主が分泌したSLを認識・発芽して寄生相手を探すことができるため、AM菌との共生シグナルであるSLを悪用していると考えられます。SLは、受容体タンパク質であるD14もしくはKAI2dに結合して活性化すると、ユビキチンリガーゼの構成要素であるMAX2タンパク質や、転写抑制因子であるSMAX1/SMAX1-Like(SMXL)との相互作用を誘導し、最終的にSMAX1/SMXLを分解に導くことでシグナルを伝達します。しかし、一連の過程が分子レベルでどのように起こるのか、詳細なメカニズムは完全には明らかになっていません。また、植物種毎にSLや受容体の構造や機能は異なるため、その都度SLの探索や受容体の機能解析などを行う必要がありますが、これらSLや受容体の活性を測定することは容易ではありません。タンパク質同士の相互作用(Protein-protein interaction; PPI)を調べることで、SLや受容体の機能が分かりますが、植物そのものや酵母を用いる手法では、化合物の代謝や毒性に留意する必要があり、SLと受容体との一対一の関係性を調べることが困難な場合があります。また、プルダウンアッセイ法※2では、定量性に乏しい上に、多検体を同時に処理できませんでした。
■研究手法と成果
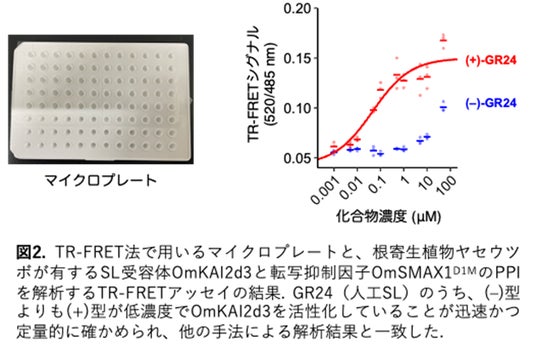
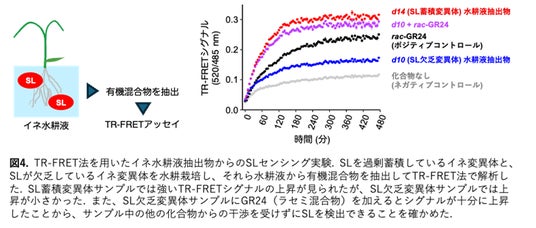
本研究グループは、SLが誘導するPPIを迅速かつ定量的に測定する手法を開発することで、SLやSL受容体の詳細な機能解析や、SL様活性を示す新たな分子を探索することが可能になると考えました。そこで、定量性・スループット性・頑健性に優れ、経時的に変化を追跡することができる時間分解Forster共鳴エネルギー移動※3(Time-Resolved Forster Resonance Energy Transfer; TR-FRET)を利用したPPI解析法を採用しました。具体的には、SL受容体へ蛍光タンパク質mEGFPを融合し、MAX2もしくはSMAX1/SMXLを発光性テルビウム(Tb)錯体で標識することで、両者が近接した際にTb錯体からmEGFPへのFRETが生じるようにデザインしました。実際の実験と解析は、タンパク質やリガンドをマイクロプレート内で混合し、mEGFPとTb錯体の蛍光強度を同時測定して比を取るという非常に簡便な操作で完結します(図1)。この方法によって、さまざまなSL類縁体の活性や、受容体のSLに対する感受性を評価することに成功しました。また、PPI誘導の時間変化を追跡することにも成功し、この特性を活かした機能解析が可能になりました(図2)。さらに、TR-FRETが夾雑物の影響を受けにくい利点を活かし、イネの根から分泌された有機混合物をTR-FRET法で調べることで、分泌物中に含まれるSLを特異的に検出することに成功しました(図3)。
■今後の期待
本成果で報告したTR-FRET法を用いることで、SLがシグナル伝達する際の分子メカニズムに関する新たな知見が得られました。今後も、本技術によってさまざまなSL類縁体や受容体の機能を簡便に解析していくことができるため、SL研究を大きく加速すると考えられます。また、さまざまな生物種由来の有機混合物や人工化合物の中から、SL受容体に対して作用する分子群をハイスループットに探すこともできるため、新たな生物学的知見を得ることや、農薬のタネとなる化合物の発見へとつながります。さらに、SLに限らず、PPIを誘導することでシグナルを伝達する植物ホルモンは数多く存在します。TR-FRETを利用したPPI解析技術は、植物ホルモンを包括的に理解するための汎用的な手法へと展開可能であり、拡張性のある技術として期待できます。
■用語解説
※1 植物ホルモン: 植物の成長を制御する化学物質の総称。一般的に植物ホルモンは、植物でごくわずかしか作られていません。これまでに、オーキシン、ジベレリン、サイトカイニン、 エチレン、ジャスモン酸、アブシジン酸、ブラシノステロイド、ストリゴラクトン、サリチル酸に加え、幾つかのペプチドホルモンなどが発見されています。
※2 プルダウンアッセイ法:タンパク質間での相互作用を試験管内で調べるための生化学的手法の一つです。あるタンパク質Aを磁性ビーズなどに固定化し、そのタンパク質との相互作用能を調べたいタンパク質Bを含む溶液と混合・洗浄した後、ビーズ上からタンパク質Bが検出されるのか否かで相互作用の有無を調べることができます。
※3 時間分解Forster共鳴エネルギー移動: Forster共鳴エネルギー移動(FRET)は、物質同士が近接した際に非接触で起こる共鳴的なエネルギー移動機構で、距離・配向・スペクトルの重なり度合いによって効率が変わります。分析化学・生物学・創薬科学などの分野では、蛍光色素同士でのFRETを利用して、分子同士が近接したことをそれぞれの蛍光強度の変化として調べる手法に利用されています。時間分解Forster共鳴エネルギー移動(TR-FRET/時間分解FRET)は、蛍光色素へ光を照射(励起)してから、蛍光を測定するまで一定時間を置くことで、蛍光寿命の長い蛍光色素由来の蛍光を選択的に検出する時間分解蛍光法と、FRET原理を組み合わせた手法です。発光性テルビウム錯体は、GFPやフルオレセインなど通常の有機蛍光色素と比べて1万倍以上も長い蛍光寿命を示すため、発光性テルビウム錯体とそれからFRETを受ける蛍光色素(本成果ではmEGFP)の蛍光を選択的に検出することができます。
■参考図

■論文情報
題目:In Vitro Dynamic and Quantitative Monitoring of Strigolactone-signaling Complex Formation by Time-resolved FRET
著者:Taiki Suzuki, Kotaro Nishiyama, Yusuke Kato, Chihiro Shinkai, Tomoya Ishikawa, Jekson Robertlee, Michio Kuruma, Shinya Hagihara, Marco Bürger, Kosuke Fukui, Tadao Asami, Yoshiya Seto
雑誌:The Plant Journal
DOI:10.1111/tpj.70624
 公式フェイスブックページ
公式フェイスブックページ